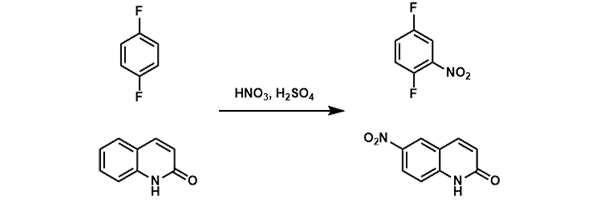
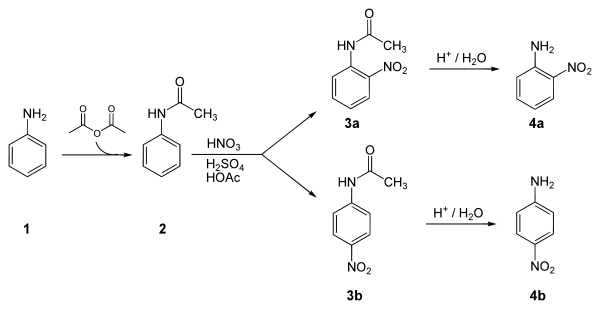
異性化による結果かは明らかではない。 2陰 性置換基の効果 ベンゼン置換体の場合に m配向性を示す陰性原子団を置換基としてもつビフェ ニルモノ置換体は,そ の置換基の位置がどこであつて も,一般に反対側のベンゼン核の2'ま たは4'の 位置パラニトロアニリンの合成 ' アニリンを無水酢酸ともに加熱するとアセトアニリドができる(アセチル化 )。 +(ch3co)2o → + ch3cooh 無水酢酸 c6h5nhcoch3 § アセトアニリドをニトロ化して得られるパラニトロアセトアニリドを、加水分解して得られる パラニトロアニリンをジアゾ化し、さらに2(2) ニトロ化 フェノールに濃硝酸と濃硫酸を加える oh 3hno3 → oh o2n no2 no2 3h2o ピクリン酸(黄色固体) (強酸性, 爆薬に利用) (参考) ベンゼン環の配向性 オルトパラ配向性(電子供与性の置換基が結合)oh, ch3, nh2, cl, br など メタ配向性(電子吸引性の置換基が
芳香族化合物の反応性
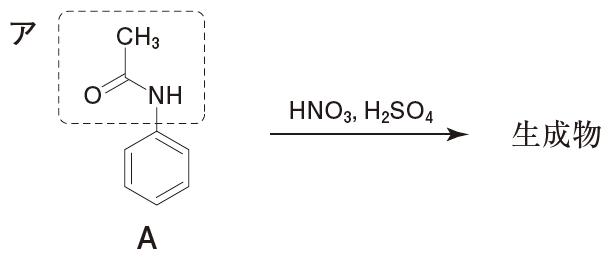
アセトアニリド ニトロ化 配向性
アセトアニリド ニトロ化 配向性- アニリン ニトロ化 配向性 質問itmedia アニリンのニトロ化 結果的にTLCの吸着剤のシリカゲル(ですよね? )と、OHとの相互作用が小さくなり、Rf値が大きくなります(すなわち、極性が小さくなります)。 4ニトロアニリンは最初のアゾ色素として知らアセトアニリド ニトロ化 アセトアニリド ニトロ化 配向性 この実験では、アセトアニリドのニトロ化反応を行い、続いて、ニトロアセトアニリドの加水 分解により pニトロアニリンを合成し、薄層クロマトグラフィー(TLC) で oニ トロアニリンが副生



2
合成 下に 4ニトロアニリンをアニリンから得る合成経路を示す。 鍵となる段階はアニリン (1) からアセチル保護したアセトアニリド (2) のアミノ基のパラ位を、混酸によりニトロ化する芳香族求核置換反応である。このとき少量生じる副生物の 2ニトロアセトアニリド (3a) を精製で除去 キーワード m配向性,o,p配向性,アセチル基,アミド基,アミノ基,エチル基,置換基効果,転位,ニトロ基,ニトロ化,配向性 今回でてきた有機化合物で,構造と名前を覚えておかなければならないもの(すでに登場したものも含む) pキシレン,pクレゾール,アセチルサリチル酸 Chem アセトアニリドで温度を高くすると、ジニトロ化などの副反応が起こる可能性が高くなったり、反応の制御か困難になったりします。, ニトロフェノールのオルト体とパラ体では沸点が相当違いますよねぇ・・・。 有機反応機構 芳香族求電子置換反応
酸性条件化ではアミノ基はメタ配向性になるはずなのですが 状態 オープン アニリンアセチル化反応機構, 有害性評価書 物質:アニリン 60 アニリンの代謝はnアセチル化、芳香環の水酸化、n水酸化と抱合又はこれらの反応の組 61 み合わせで行なわれる。もくじ 1 芳香族求電子置換反応は場所が異なる 11 置換基による共鳴効果(r効果);70以上 アセトアニリド ニトロ化 濃硝酸 滴下 アセトアニリド ニトロ化 濃硝酸 滴下 配向性を知っておかなければならない反応と言うのは、実は、 2段階反応 だということです。
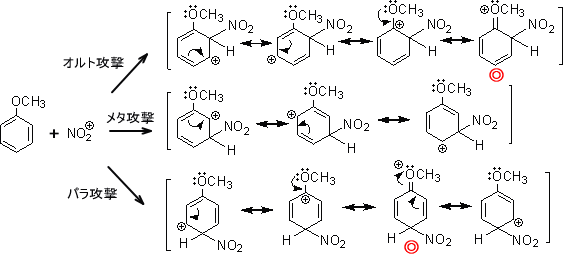
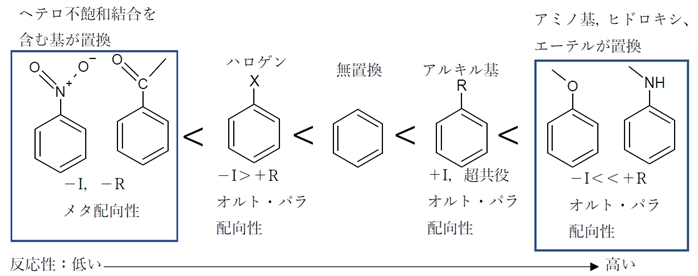
性化置換基 activating substituent と呼ぶ。また、メチル基は芳香族求電子置換反応をオ ルト位・パラ位に優先的に起こさせる効果がある。このような置換基の性質を、オルト・ パラ配向性 ortho–para directing と呼ぶ。 3 活性化置換基にはどのようなものがあるか空気がないと あと、ニトロ基がくっつく位置が必ず2,4,6、って位置になる理由を教 質 文献「クロルトルエンスルホン酸のニトロ化における配向性」の詳細情報です。jglobal 科学技術総合リンクセンターは研究者、文献、特許などの情報をつなぐことで、異分野の知や意外な発見などを2 ベンゼン環の配向性は電子供与性・電子吸引性で異なる 21 フェノールやアニリンは電子供与基:オルト・パラ配向性;



ニトロベンゼン



放課後化学講義室 今日の分子no 33 アセトアニリド
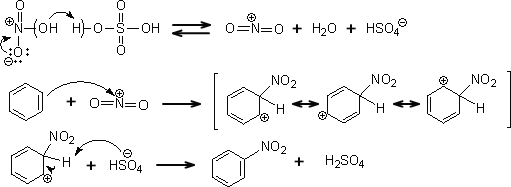
この反応をニトロ化 nitration と呼ぶ。 エネルギー 反応座標 e h e e h アレニウム イオン中間体 ono n o o rr–x r rco r c o x c o r x 2 x ho o o s o o oh q フェノールのニトロ化について プロモニウムイオンとベンゼニウムイオン 反応性一選択性の原理 36など意味不明な反応が多くあります。 求電子種と求核種および化学種と分子種 31 ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。この温度の違いはなぜですか?教えてください。本題に入る前に、簡単に前回の復習をします。前回、ベンゼンおよびフェノールの臭素化について比較し、次の疑問をあげました。 1 を参照してみてください。, 先日実験をして、pーニトロアニリンを合成する際に、得られたp-ニトロアセトアニリドの結晶の洗浄が不十分のまま加水分解を




ニトロ化合物 Wikipedia



芳香族化合物の反応性
配向性を学ぶための前提知識 配向性とは? 配向性を知っておかなければならない反応と言うのは、実は、 2段階反応 だということです。 ベンゼン環に2番目に置換するx 陽イオンは、 先に置換した官能基に左右される ということです。 というのは、1 つ目の置換基の影響を受けるから、2ニトロアセトアニリドの水への溶解性 oニトロアセトアニリド:水に可溶;熱水に易溶。 pニトロアセトアニリド:水に難溶(01 mg/mL, ℃)、熱水に可溶。 (17) この段階で2 g程度のニトロアセトアニリドが得られるはずである。 アセトアニリドのニトロ化では、アセチルアミノ基のかさ高さが、立体障害となって、オルト位に入りにくいのではないでしょうか。 オルトメタル化(オルトメタルか、Directed ortho metalation、略称DoM)とは、アリールリチウム中間体を経て求電子剤が指向性




有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ




有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ
硝酸以外のニトロ化剤を用いるときも,と きどきその 配向が変わる。た とえばアセトアニリドのニトロ化を ℃ の硝酸で行うとき,omp=の 比でニトロ化物を得るが,ト ルエンのときは,表1の ように,ほ ぼ一定のoρ 比である。このときmニ ト 化学 メタ配向性不活性・・・? 有機の問題です。-NO2はメタ配向性不活性化基とテキストにかいてありましたが、ニトロベンゾニトリルの生成ではmニトロベンゾニトリルが主成分となってます。どうしてで 質問Noトルエンのニトロ化はベンゼンよりも速い 安息香酸エチルのニトロ化はベンゼンよりも遅い ch3 hno3 ac2o no2 ch3 no2 4% 96% c hno3 ac2o ooch2ch3 no2 c no2 996% 045% ooch2ch3 芳香族求電子置換反応の置換基効果①:反応速度



芳香族炭化水素



1
目次 1 配向効果と活性化効果11 反応速度が異なる理由 配向効果と活性化効果 芳香環に置換基が一つ結合している場合、 求電子剤がさらに芳香環と反応すると3種の異性体が生じる。 オルト(ortho:1,2二置換)体 メタ(meta:1,4ニトロアニリン、または pニトロアニリン(パラニトロアニリン) は、有機化合物のひとつで、ベンゼンのパラ位の水素がアミノ基とニトロ基が置き換わった構造を持つ。 色素や医薬品合成の中間体、酸化防止剤、ガソリンのガム状化防止剤、家禽の医薬品、腐食防止剤としての用途がある。 ベンゼンのニトロ化では50~60℃が最適温度で、アセトアニリドのニトロ化では15~℃が最適温度でした。この温度の違いはなぜですか?教えてください。 c6h5nh2(ch3co)2o →c6h5nhcoch3 ch3cooh エステル化、或いはエステルの加水分解で、硫酸を触媒として




ナフトールの配向性 ベンゼンの置換基によってオルト パラ配向性 メ 化学 教えて Goo




第101回薬剤師国家試験 問103 Yakugaku Lab
ニトロ化を先にすると メタ配向であるほか、ニトロベンゼンは反応性が極めて低くフリーデルクラフ ツ反応を起こさない。 (3)トルエンのニトロ化によりオルト位にニトロ基を導入して、ベンジル位 あと、ニトロ基がくっつく位置が必ず2,4,6、ってオルトに対し、隣の隣(1位と3位)をメタ (meta , m) 、反対側(1位と4位)をパラ (para , p) という。 また、ある置換基に注目したとき、その隣の位置をオルト位と呼ぶ。 水和度の違うオキソ酸 オルト位とパラ位に負 電荷が非局在化 (補足)非共有電子対5 12 アセトアニリドへの求電子的ニトロ化反応は、メタ位に比べ、オルト位及びパラ 位に優先して起こる。 13 ニトロベンゼン、安息香酸、アセトフェノンはすべてメタ配向性である。 14 phenol はtoluene よりも求電子試薬との反応が速い。 15 化合物A のニトロ化を行った時、予想される主生成物



ニトロ化反応 Nitration 合成技術 研究 生産品目 合成技術 日本理化学




Sandmeyer反応はアニリンを起点とする官能基導入法 とらおの有機化学
キル基も電子供与性なので活性化基である。ニトロ基は強力な不活性化基であ るので、簡単にはニトロ化は起こらず、発煙硝酸などを用いる。 10-a4 ヒドロキシル基はオルトパラ配向である。 アシル基はメタ配向である。電子吸引性官能基はm配向で低い反応性 一方で、パラ位での反応が起こったとすると この共鳴構造式は二つの正電荷が隣り合う原子に存在 不安定なため、共鳴安定化にはほとんど寄与しない NO 2をきちんと書くとこうなる アセトアニリドはオルトメタ配向性ということなので、 ニトロ化すると生成物のほとんどがoニトロアセトアニリドとpニトロアセトアニリドだと思うのですが、 oニトロアセトアニリドよりもpニトロアセトアニリドのほうが多く生成される理由は、 分子




第101回薬剤師国家試験 問103 Yakugaku Lab



4 ニトロアニリン Wikipedia
・配向性と反応性, 1は、ベンゼンに結合しているアミノ基が電子供与性のため、オルト、パラ配向性になります。したがって、正解, 2は、アセトアニリドは電子供与性ですが、メタの位置にニトロ化されているため、誤り。, 3は、安息香酸はカルボキシル基アセトアニリド 求電子置換反応(ニトロ化)の配向性・反応性 95回薬剤師国家試験問10b 芳香族化合物に関する記述の正誤を判定してみよう。 b アセトアニリドヘの求電子的ニトロ化反応は、メタ位に比べ、オルト位及びパラ位に優先して起こる。得られた粗アセトアニリドを再結晶法によって精製する.再結晶溶媒として希酢酸(酢酸:水=12,体積比)約 25 ml を入れた 50 ml ビーカーに,粗アセトアニリドをブフナーロートから移し取る. (ビンの蓋についた結晶も,薬さじを使ってできるだけ回収する).結晶が完全に溶解する




ニトロ化合物 Wikiwand



2
アセトアニリド 求電子置換反応(ニトロ化)の配向性・反応性 95回薬剤師国家試験問10b 芳香族化合物に関する記述の正誤を判定してみよう。 b アセトアニリドヘの求電子的ニトロ化反応は、メタ位に比べ、オルト位及びパラ位に優先して起こる。 bアセトアニリド 求電子置換反応(ニトロ化)の配向性・反応性 95回問10b 第95回薬剤師国家試験 問10b芳香族化合物に関する記述の正誤を判定してみよう。√100以上 アセトアニリド ニトロ化 配向性 アセトアニリド ニトロ化 配向性 うた ☆ プリ リングライト, 薬学部に入って有機化学を学び始めると登場する、最初の壁だと思います。 電子求引基と電子供与基 の簡単な理解方法を解説します。



アニリンのニトロ化の反応機構を教えてください その質問 Yahoo 知恵袋



写真で示すニトロベンゼンを出発原料とする5 クロロ 2ニトロアニリンの Yahoo 知恵袋




有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ




P ニトロベンゼンのモノニトロ化配向性 ニトロ基がついているので 電子吸 Okwave
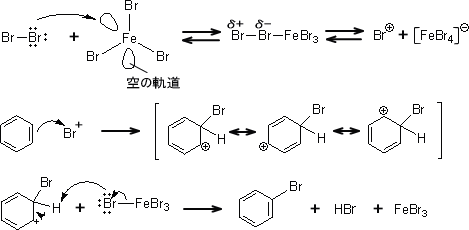



芳香族化合物の反応性




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学
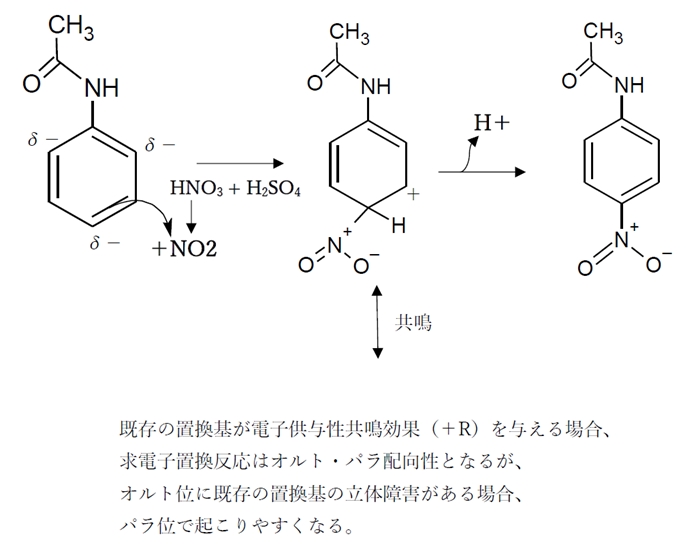



薬学 芳香族求電子置換反応 薬剤師国家試験過去問題105回問104




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学




誘起効果 共鳴効果の酸性度 電子供与基と電子吸引基の違い リョースケ大学
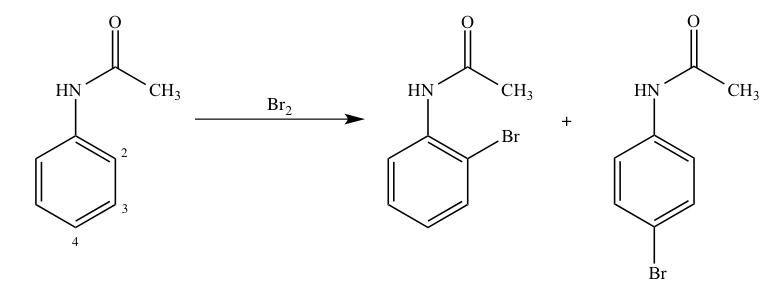



第101回薬剤師国家試験 問103 Yakugaku Lab



2




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学



pアセトトルイジンのニトロ化について質問ですニトロ基の配向性でニトロ基がメタの Yahoo 知恵袋



環化 問6



2




第101回薬剤師国家試験 問103 Yakugaku Lab



ニトロベンゼン 電子的黙示録



3




芳香族化合物の反応性




Pcゲーマーな薬学生の奮闘記 有機化学



有機反応機構 芳香族求電子置換反応



2



放課後化学講義室 今日の分子no 62 ニトロベンゼン




ナフトールの配向性 ベンゼンの置換基によってオルト パラ配向性 メタ配向 Okwave
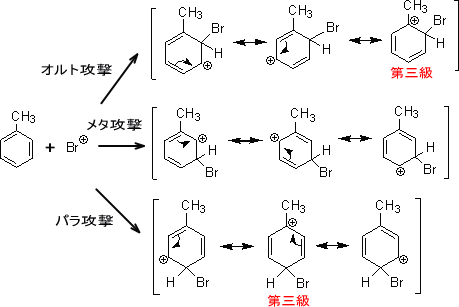



芳香族化合物の反応性



有機反応機構 芳香族求電子置換反応



共鳴構造式を教えてください アニリン メトキシベンゼン ニトロベンゼ Yahoo 知恵袋



有機化学ニトロ化のおこりやすい位置について と てはどちら Yahoo 知恵袋




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学



環化 問6



有機反応機構 芳香族求電子置換反応



2



2
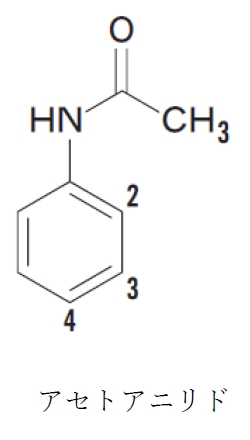



アセトアニリド 求電子置換反応 ニトロ化 の配向性 反応性 95回問10b




4 ニトロアニリン Wikipedia



有機反応機構 芳香族求電子置換反応




エステルがあるベンゼンのモノニトロ化するときの配向性 Okwave



アニリンのニトロ化の反応機構を教えてください その質問 Yahoo 知恵袋




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学




芳香族化合物の配向性と反応性 オルト メタ パラの配向性 リョースケ大学



2
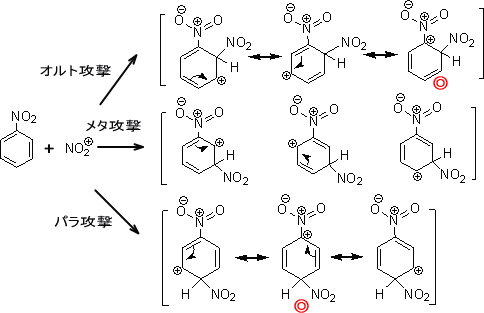



芳香族化合物の反応性



環化 問6
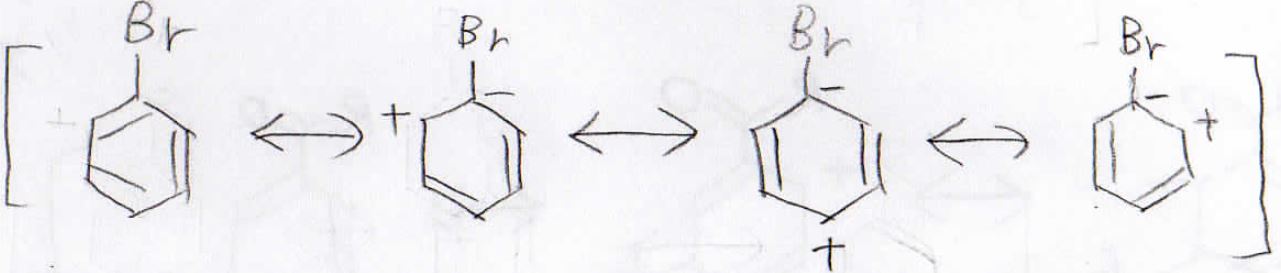



大学の有機化学 芳香族化合物の配向性と活性化度を暗記なしで完全マスター ばけライフ



環化 問6



2



看護学部の化学講義 25 ベンゼン環を含む有機化合物 Life Chemistry




芳香族化合物のニトロ化 Nitration Of Aromatic Compounds Chem Station ケムステ



放課後化学講義室 オルト メタ パラ そしてイプソ




芳香族求電子置換反応 Wikipedia
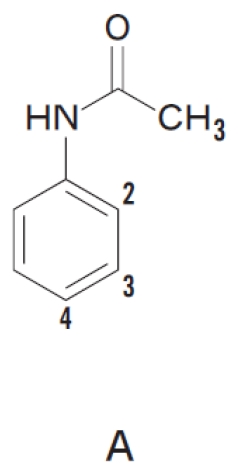



アニリン アセトアニリド アミノ基置換ベンゼン のオルト パラ配向性 101回問103の
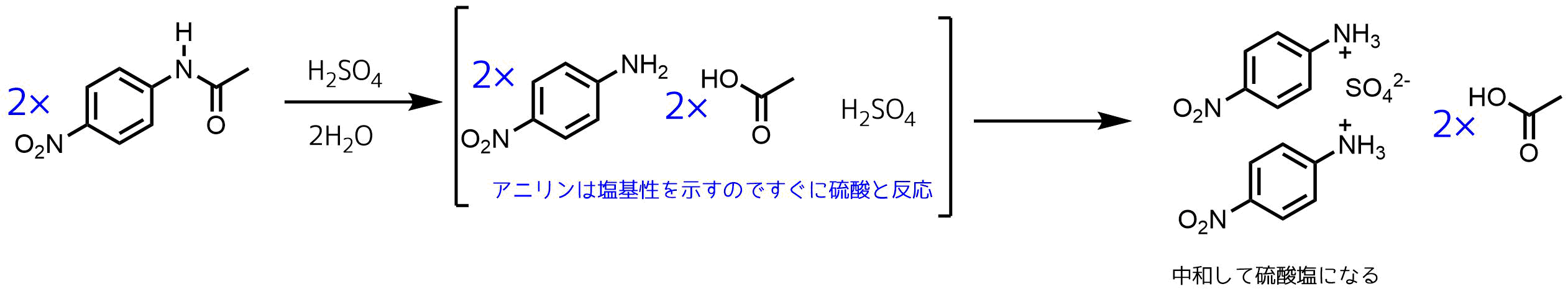



25 アセトアニリド ニトロ化 温度 アセトアニリド ニトロ化 温度 Jossaesipt7qn




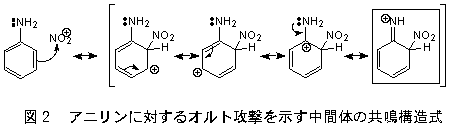
アニリンのニトロ化の生成過程 反応中間体の共鳴式 Okwave



2



有機化学第一教室



アセトアニリド 求電子置換反応 ニトロ化 の配向性 反応性 95回問10b



医療工14



有機反応機構 芳香族求電子置換反応




ベンゼンへの求電子置換反応とフェノールのオルトパラ配向性について Youtube



P ニトロアセトアニリドからp ニトロアニリンへの反応機構 Okwave




有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ



ニトロアセトアニリドの脱保護について教えてください 実験のレポー Yahoo 知恵袋



2



放課後化学講義室 今日の分子no 62 ニトロベンゼン



有機反応機構 芳香族求電子置換反応



1



薬学 芳香族求電子置換反応 薬剤師国家試験過去問題105回問104




アニリンのニトロ化 アニリンをニトロ化する際 直接ニトロ化するので 化学 教えて Goo



環化 問6



先日ニトロアセトアニリド合成の実験を行い 現在レポート製作中なのです Yahoo 知恵袋



2
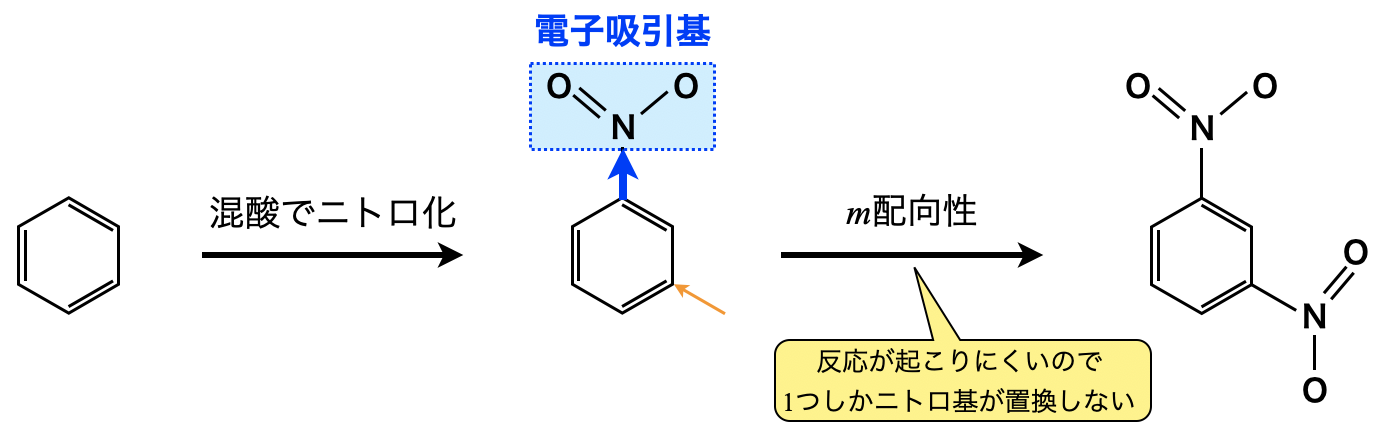



芳香族の反応ってどうやって覚えるの 置換基の性質を理解して反応の本質をおさえよう 高校化学のものがたり




P ニトロアセトアニリドのさらなるニトロ化 大学の学生実験においてア 化学 教えて Goo
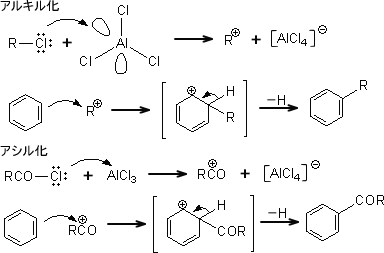



芳香族化合物の反応性
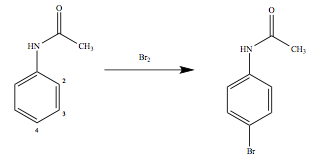



薬剤師国家試験 第101回 問103 過去問解説 E Rec わかりやすい解説動画




高等学校化学ii 有機化学 Wikibooks



有機反応機構 芳香族求電子置換反応




Pcゲーマーな薬学生の奮闘記 有機化学



放課後化学講義室 オルト メタ パラ そしてイプソ




ニトロベンゼンからアニリンを合成する語呂合わせなど 17h29大学入学共通テスト試行調査第1回第3問 問4 語呂合わせで高校化学 大学入試ゴロ化学
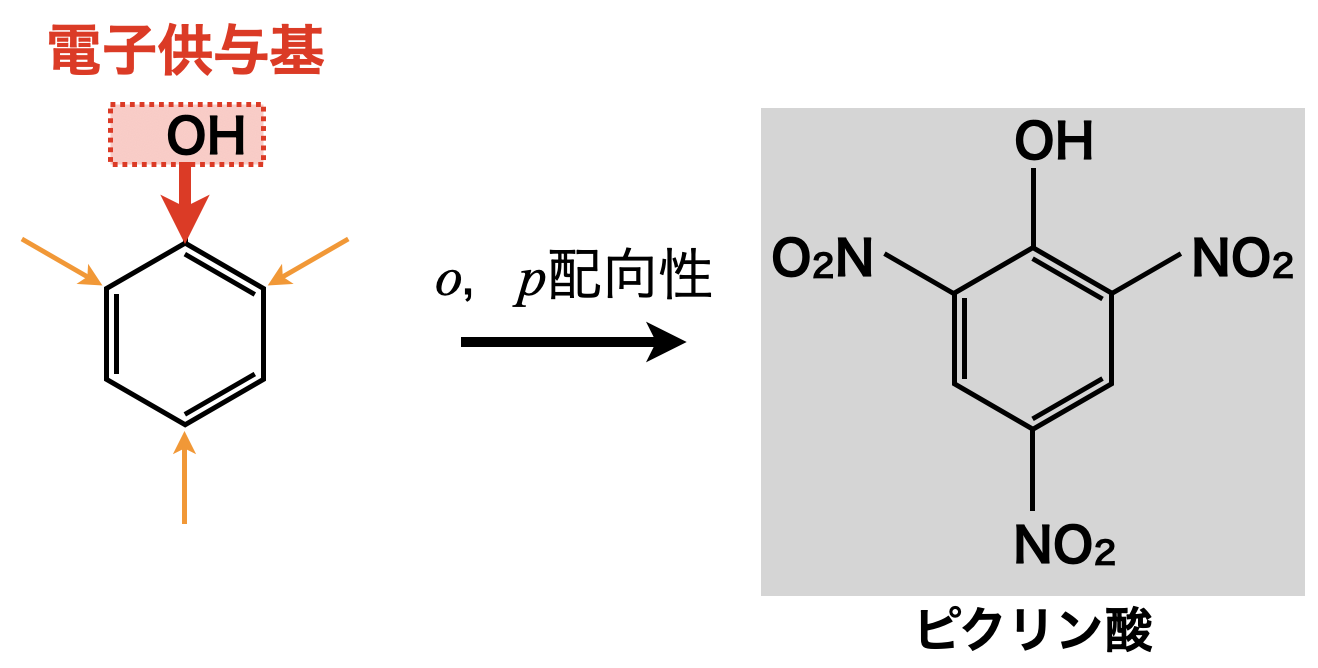



芳香族の反応ってどうやって覚えるの 置換基の性質を理解して反応の本質をおさえよう 高校化学のものがたり



アセトアニリドをニトロ化する際 固体のアセトアニリドに濃硫酸 Yahoo 知恵袋




オルトパラ配向性とメタ配向性 芳香族求電子置換反応 Youtube



25 アセトアニリド ニトロ化 温度 アセトアニリド ニトロ化 温度 Jossaesipt7qn



2



先日ニトロアセトアニリド合成の実験を行い 現在レポート製作中なのです Yahoo 知恵袋



放課後化学講義室 今日の分子no 62 ニトロベンゼン




有機反応を俯瞰する ー芳香族求電子置換反応 その 2 Chem Station ケムステ



No comments:
Post a Comment